Deux chercheurs de Skoltech et de l'Université McGill ont publié une revue du domaine de recherche prometteur connu sous le nom de protéomique structurale dans l'influente revue Chemical Reviews. Ce domaine combine la chimie des protéines et la spectrométrie de masse, une technique analytique avancée permettant d'identifier la composition chimique des substances sur la base d'une masse précise. L'objectif ultime est de résoudre la structure détaillée des protéines et donc de comprendre les processus pathologiques, comme la maladie d'Alzheimer, au niveau moléculaire et de prédire plus rapidement et plus efficacement les candidats-médicaments contre diverses maladies.
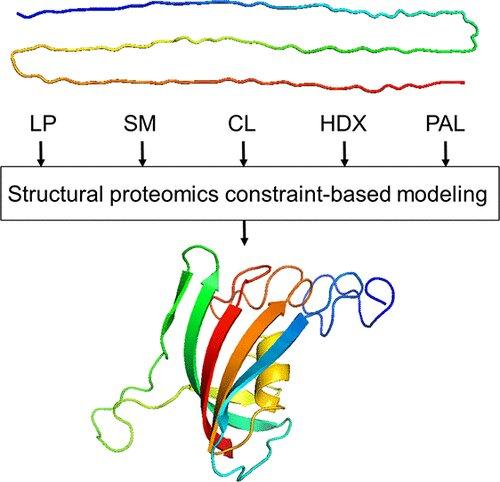
La protéomique structurale s'intéresse à l'identification de la structure des protéines en interaction et des sites sur les protéines qui interagissent avec d'autres protéines, y compris des anticorps, ou avec des molécules médicamenteuses. Ceci est rendu possible par un ensemble de techniques apportant des données structurales complémentaires : modification de surface, protéolyse limitée, échange hydrogène-deutérium, réticulation.
« Considérez une situation avec de graves implications pour la santé, où deux protéines sont fusionnées. Parfois, vous devez empêcher ce blocage de se produire. Par exemple, on pense que ce processus est à l'origine de certains cancers », a commenté le co-auteur de l'étude et professeur invité de Skoltech, Christoph Borchers.
Outre la détermination des sites d'interaction des protéines, un autre aspect important de la protéomique structurale consiste à explorer les effets des soi-disant changements de conformation. Il s'agit de protéines adoptant différentes configurations spatiales sans aucune modification de leur composition chimique : simplement en se pliant en formes. Les chercheurs étudient les changements de conformation parce qu'ils affectent les sites d'interaction sur les protéines qui sont réellement exposés et donc disponibles pour les molécules de médicaments ou d'autres protéines.
"Dites, vous avez un changement de conformation" malsain "pour une raison quelconque", a déclaré Borchers. "Tout d'un coup, une interaction se produit et la prochaine chose que vous savez - les protéines commencent à s'agréger et une plaque de fibres se forme - c'est ce qui se passe dans les maladies d'Alzheimer et de Parkinson. Nous devons savoir ce qu'est ce changement de conformation pathologique, ainsi que la structure de l'agrégat résultant.
"L'intelligence artificielle a beaucoup d'importance ici. Bien qu'il ne puisse pas tout expliquer, il ajoute certainement beaucoup. Nous pouvons faire beaucoup pour comprendre les changements de conformation et leur rôle dans les maladies neurodégénératives, par exemple - en combinant la chimie des protéines, la modélisation moléculaire et l'IA ", a ajouté le co-auteur de l'étude, Evgeniy Petrotchenko, citant cela comme peut-être la plus grande application. de la protéomique structurale.
"Parce que bien sûr, les gens vieillissent, mais ils contractent toujours soit un cancer, soit des maladies neurodégénératives, soit des maladies cardiovasculaires [maladies cardiovasculaires]", a poursuivi Borchers, notant que 90% de tous les nouveaux médicaments anticancéreux sont des anticorps - et la protéomique structurelle peut déterminer les protéines -interactions d'anticorps, aussi.
"C'est un domaine très excitant", a déclaré le chercheur. « Nous le faisons depuis près de 30 ans maintenant, et nous avons fait de grands progrès dans le développement de progiciels pour déchiffrer les changements dynamiques qui échappent aux outils d'analyse structurelle conventionnels, tels que la cristallographie aux rayons X, la résonance magnétique nucléaire ou la microscopie électronique. Et nous avons développé une palette d'approches complémentaires : études de réticulation, échange hydrogène-deutérium, etc.
Une autre chose à propos de la protéomique structurale est l'échelle à laquelle elle opère. Imaginez qu'il y ait un médicament dont vous deviez caractériser le mode d'action : où exactement se lie-t-il à la protéine cible ? (Les protéines sont, en fait, les molécules ciblées par la grande majorité des médicaments.) La fonction d'une protéine est définie par sa structure, et la protéomique structurale peut déterminer la structure non seulement d'une protéine mais de plusieurs, impliquées dans une interaction simultanée. . «Nous examinons des centaines d'interactions protéine-protéine à la fois. Nous examinons l'ensemble du réseau protéique. Cela ne peut pas être fait par d'autres techniques », a expliqué Borchers. "Comme avec un orchestre: il faut considérer l'ensemble."
Référence : Petrotchenko EV, Borchers CH. Chimie des protéines combinée à la spectrométrie de masse pour la détermination de la structure des protéines. Chem Rev. 2021. doi : 10.1021/acs.chemrev.1c00302
Cet article a été republié à partir des documents suivants. Remarque : le matériel peut avoir été modifié pour la longueur et le contenu. Pour plus d'informations, veuillez contacter la source citée.









