La pile à combustible la plus simple « brûle » de l'hydrogène dans une réaction chimique sans flamme pour produire de l'électricité. Afin de "brûler" l'hydrogène, une pile à combustible a besoin d'une source d'oxygène, qui est généralement obtenue à partir de l'air. Le seul sous-produit de ce type de pile à combustible est l'eau.
Contrairement à une batterie, une pile à combustible ne stocke pas de produits chimiques pour produire de l'énergie. Une pile à combustible produira de l'électricité tant que du combustible et de l'oxygène seront fournis.
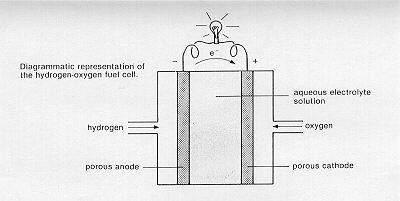
Le circuit dans une simple pile à combustible
Une pile à combustible simple est constituée de deux conducteurs (une anode et une cathode) séparés par un conducteur ionique – un électrolyte – (par exemple, une solution saline). L'hydrogène est pompé vers l'anode et l'oxygène vers la cathode. L'hydrogène réagit avec les particules chargées (ions) dans l'électrolyte, produisant de l'eau et des électrons. Les électrons quittent la pile à combustible le long des fils ; c'est le courant électrique généré par la cellule. Les électrons retournent à la cathode de la pile à combustible où ils se combinent avec l'oxygène et l'eau pour former des ions qui remplacent ceux consommés à l'anode. Et ainsi le cycle se poursuit, l'hydrogène et l'oxygène étant transformés en eau tout en générant de l'électricité.
Des piles à combustible simples dans l'espace
Chaque pile à combustible simple génère jusqu'à 1,23 volts. Les cellules individuelles peuvent être câblées ensemble pour produire des tensions plus élevées ou un courant plus élevé. La navette spatiale, par exemple, possède 96 cellules individuelles disposées en trois piles. Lorsque l'hydrogène et l'oxygène sont pompés dans les piles à combustible de la navette, ils génèrent 28 volts de courant continu ainsi que de la chaleur et de l'eau. La chaleur est utilisée à bon escient, vaporisant les combustibles liquides avant qu'ils n'atteignent les piles à combustible. L'eau s'écoule dans des conteneurs de stockage pour la consommation et d'autres usages.
Différents types de piles à combustible
Les piles à combustible reposent sur un principe simple. Cependant, les réactions chimiques impliquées ne se produisent pas facilement. À moins que des matériaux spéciaux ne soient utilisés pour construire les cellules, très peu de courant électrique est produit. Une grande partie de la recherche avec les piles à combustible commerciales s'est concentrée sur le développement d'électrolytes appropriés.
Les piles à combustible à acide phosphorique, utilisant de l'acide comme électrolyte et alimentées par de l'hydrogène gazeux, sont le type de pile à combustible le plus développé commercialement. Ils sont utilisés à l'étranger dans les hôpitaux, les maisons de retraite, les hôtels, les bureaux et les écoles.
Les piles à combustible à carbonate fondu promettent un rendement élevé et peuvent être alimentées par des combustibles à base de charbon tels que le monoxyde de carbone au lieu de l'hydrogène gazeux. Ces cellules doivent fonctionner à des températures élevées (autour de 650°C) car elles possèdent un électrolyte carbonate qui doit être conservé sous forme liquide.
Une société australienne, Ceramic Fuel Cells Ltd, développe commercialement des piles à combustible à oxyde solide hautement efficaces (également appelées piles à combustible céramiques). Ces cellules, contrairement à leurs prédécesseurs, possèdent un électrolyte solide séparant les deux électrodes. Les piles peuvent être alimentées par une variété de gaz, y compris l'hydrogène, le gaz naturel ou le gaz de charbon.
Ils promettent d'être très efficaces. Ils fonctionnent à 800°C et les gaz d'échappement chauds peuvent être acheminés vers une turbine, extrayant encore plus d'électricité.
L'électrolyte solide est constitué d'une membrane céramique exceptionnellement résistante en zircone. La zircone, ou oxyde de zirconium, est un composé du métal zirconium. (Idéalement, 70 pour cent de l'approvisionnement mondial de ce métal provient d'Australie.) Chauffez la zircone et vous obtenez un électrolyte à l'état solide capable de transmettre rapidement des ions d'oxyde de la cathode à l'anode.
L'astuce pour faire migrer les ions oxyde à travers l'électrolyte solide est d'ajouter de minuscules quantités de l'élément yttrium, un métal gris argenté, à la zircone pendant la fabrication. Le réseau cristallin d'oxyde de zirconium (ZrO2) a deux ions d'oxyde pour chaque ion de zirconium. Mais dans l'oxyde d'yttrium, il n'y a que 1,5 ions d'oxyde pour chaque ion d'yttrium. Le résultat : des lacunes dans la structure cristalline où manquent les ions oxyde. Ainsi, les ions oxyde de la cathode sautent de trou en trou jusqu'à ce qu'ils atteignent l'anode.
Une fois à l'anode, les ions oxyde réagissent facilement avec n'importe quel combustible gazeux qu'ils rencontrent - monoxyde de carbone, hydrogène ou méthane - libérant de l'électricité.
Les piles à combustible à membrane échangeuse de protons (PEM), également appelées piles à combustible à électrolyte polymère, sont la technologie la plus prometteuse pour les applications de transport. Construites à partir de composants de carbone et de polymère et fonctionnant à 60-90 °C, les piles à combustible à membrane échangeuse de protons sont légères et permettent un démarrage et un arrêt rapides. Ils sont également très compacts.









